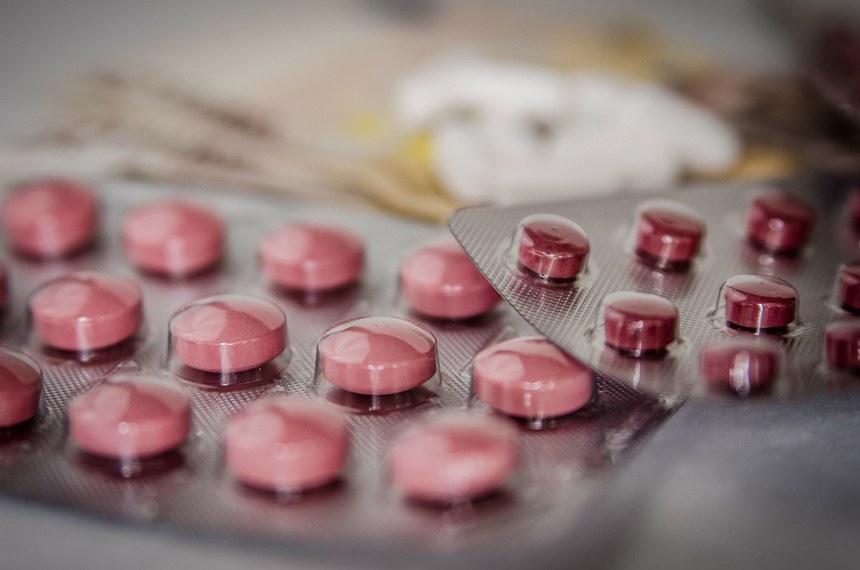
Os chamados “medicamentos órfãos”, que se destinam ao tratamento de doenças raras e são produzidos no exterior, poderão receber tratamento legal que facilite sua importação e seu registro nos órgãos sanitários do Brasil. É o que estabelece o Projeto de Lei do Senado (PLS)31/2015, do senador Alvaro Dias (PV-PR), que a Comissão de Assuntos Econômicos (CAE) vai apreciar em reunião marcada para a próxima terça-feira (15), às 10h.
São consideradas raras as doenças cuja incidência não ultrapasse a 65 casos por 100 mil habitantes. Em muitos casos, o número de doentes é tão pequeno que acaba afastando, por restrição de mercado, o interesse da indústria farmacêutica na fabricação. Daí, a designação de “medicamento órfão”. Com o projeto, as pessoas afetadas por essas doenças deverão enfrentar menos obstáculos para as aquisições de modo direto. As empresas importadoras também ficarão livres de parte das atuais exigências burocráticas para buscar os medicamentos no exterior.
Na visão do autor, a burocracia envolvida na importação dos medicamentos talvez seja a pior das barreiras produzidas pelo Estado. Alvaro Dias acrescenta que sua proposta busca “mitigar o problema de um número significativo de pessoas cuja saúde e vida dependem da importação desses medicamentos ausentes do mercado nacional e que sofrem com as dificuldades e as incertezas desse processo”.
Exceção
O projeto define claramente uma exceção à regra atual que veda a importação de medicamentos, drogas e insumos farmacêuticos sem prévia autorização do Ministério da Saúde, para favorecer a importação desses fármacos diretamente por pessoas físicas, em quantidade adequada para uso individual. Hoje, a importação pode ser feita de modo direto pelo usuário, desde que o produto conste de lista elaborada pela Agência Nacional de Vigilância Sanitária (Anvisa) de medicamentos para doenças raras. Com o projeto, a lógica será inversa: a lista será composta dos medicamentos submetidos a regime especial de controle e que não se destinem à revenda ou comércio. Somente esses não poderão ser livremente importados.
Já o procedimento de autorização para a importação de “medicamento órfão” por empresa importadora deverá seguir rito simplificado, a ser regulamentado pelo governo. Pelo texto, será inclusive dispensada a exigência de registro prévio do fármaco no Ministério da Saúde quando o produto tiver sua comercialização aprovada pelo órgão oficial de registro da União Europeia ou dos Estados Unidos. A ideia é que, com menos burocracia, o acesso do doente a esses medicamentos seja facilitado.
A matéria conta com o apoio do relator, senador Ronaldo Caiado (DEM-GO). Para ele, é inegável que o projeto traz benefícios para a população. Segundo o senador, o mérito da proposta é desburocratizar as exigências de autorizações e registros prévios, que atuam no sentido de coibir o alcance dos enfermos a esses medicamentos. Se aprovado, o projeto seguirá para a análise da Comissão de Assuntos Sociais (CAS), onde vai tramitar em caráter terminativo.
Outros projetos
Na mesma reunião, a CAE deve votar o substitutivo do senador Ricardo Ferraço (PSDB-ES) ao PLS 229/2009. Do senador Tasso Jereissati (PSDB-CE), o texto estabelece normas gerais sobre orçamento, controle e contabilidade pública, visando tornar mais realista o Orçamento da União. A matéria estava na pauta da reunião da semana passada, mas um pedido de vista coletivo adiou a votação.
A CAE também deve votar o PLS 195/2012, que torna obrigatório o uso de sistema antitravamento das rodas (ABS) nos carros, e o PLS 326/2013, que regulamenta o trabalho a distância.
Fonte: Portal do Senado